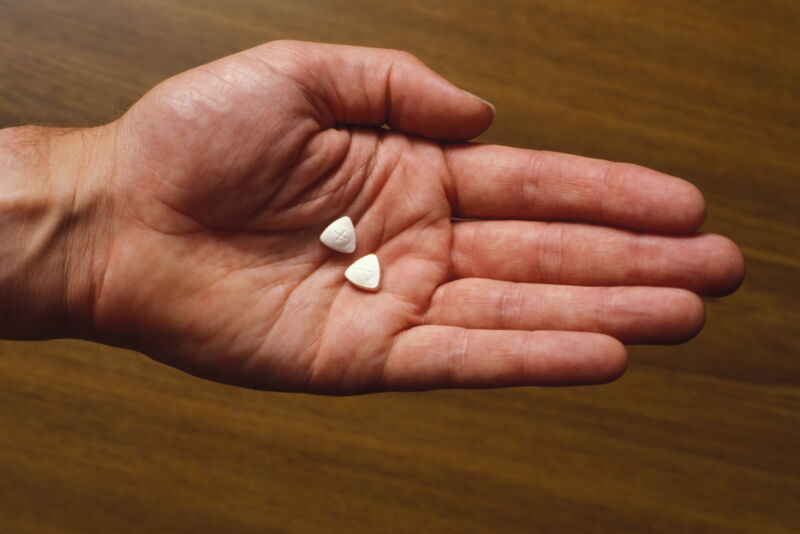
科学雑誌は、心的外傷後ストレス障害の心理療法としてのエクスタシーとしても知られるMDMAの臨床開発を裏付ける3つの研究をレビューした。この動きは、2つの第III相臨床試験で肯定的な結果が報告されたにもかかわらず、食品医薬品局がこの治療法を拒否したというニュースが広まったわずか1日後に行われた。
この治療法を開発しているライコス・セラピューティクスは金曜日、次のように発表した。 食品医薬品局から拒否通知を受け取ったと発表したライコス氏は、この書簡は同庁とその専門家諮問委員会が6月に圧倒的多数で治療承認に反対票を投じたことで以前に提起された多くの懸念を反映していると述べた。 FDAとその顧問は、臨床試験の設計における欠陥、データの欠落、サイケデリック物質の支持疑惑など、試験参加者におけるさまざまな偏見を特定した。 Lycos は、非営利の学際的サイケデリック研究協会 (MAPS) の商業子会社です。
FDAアドバイザーも注目 性的暴行の公の申し立て MDMA支援心理療法を提供する無資格のセラピストによって実施された第II相試験中の試験参加者より。
ライコスは金曜の声明で、FDAが同社に追加の第3相臨床試験を実施するよう要請したが、同社はこれを「非常に残念」な要請だと述べた。 LycosはFDAの決定に対して控訴すると述べた。
撤回
Lycos CEO のエイミー氏は、「新たな第 3 相試験を実施するには数年かかるかもしれないが、以前に FDA と協議し、諮問委員会で提起された要望の多くは既存のデータ、要件、要件で対応できると引き続き信じている」と述べた。エマーソン氏は声明で、承認後、または科学文献を参照して述べた。
土曜日、リコス氏にとって、MDMA治療をサポートするために既存の科学データや文献を利用することがより困難になった。学術誌「Psychopharmacology」は、治療の第 2 段階の臨床データを含む 3 つの研究のリコール通知を掲載しました。研究が含まれています 2019 年の第 III 相試験の設計の理論的根拠、 2020年の集計分析そして、その方法について2020年に実施された調査では、 抗うつ薬の使用はMDMA治療への反応に影響を与える可能性がある。
撤回通知では、臨床試験会場の1つでの「非倫理的行為に相当するプロトコル違反」(性的暴行の申し立てに言及)と、著者らによる未公開の利益相反など、撤回の2つの理由を挙げている。
性的暴行について同誌は、「投稿者らは投稿時にこれらの違反行為を認識していたことを後に確認した」と述べた。 [the articles] しかし、彼らはこの情報をジャーナルに開示したり、このサイトによって生成されたデータを分析から削除したりしませんでした。利益相反に関して、同誌は、MAPSが研究に資金を提供したという事実にもかかわらず、著者らはMAPSおよびその関連会社であるMAPS Public Benefit Corporationとの関係を完全には開示していないと主張している。
Lycosがニューヨーク・タイムズに出した声明によると、記事を取り下げる決定には同意しないという。 「論文は依然として科学的に健全であり、PTSDの潜在的な治療法の研究に重要な貢献をする」と同社は述べた。

「アマチュア主催者。ビールの伝道者になりたい。一般的なウェブファン。認定インターネット忍者。熱心な読者。」





More Stories
第4四半期の米国経済成長率は年率3%と好調に修正された
人工知能チップ大手エヌビディアの株価は、300億ドルという記録的な売上にも関わらず下落した
フォードもハーレーダビッドソン、ディア、ローズに加わりDEIから撤退